KATHETERINFEKTIONEN VERMEIDEN
Katheterassoziierte Infektionen erhöhen Mortalitätsrisiken und Therapiekosten. Dabei lassen sich die meisten Infektionen vermeiden.
Risiken
Der Klinikalltag birgt zahlreiche Risiken für katheterassoziierte Infektionen.
Folgen
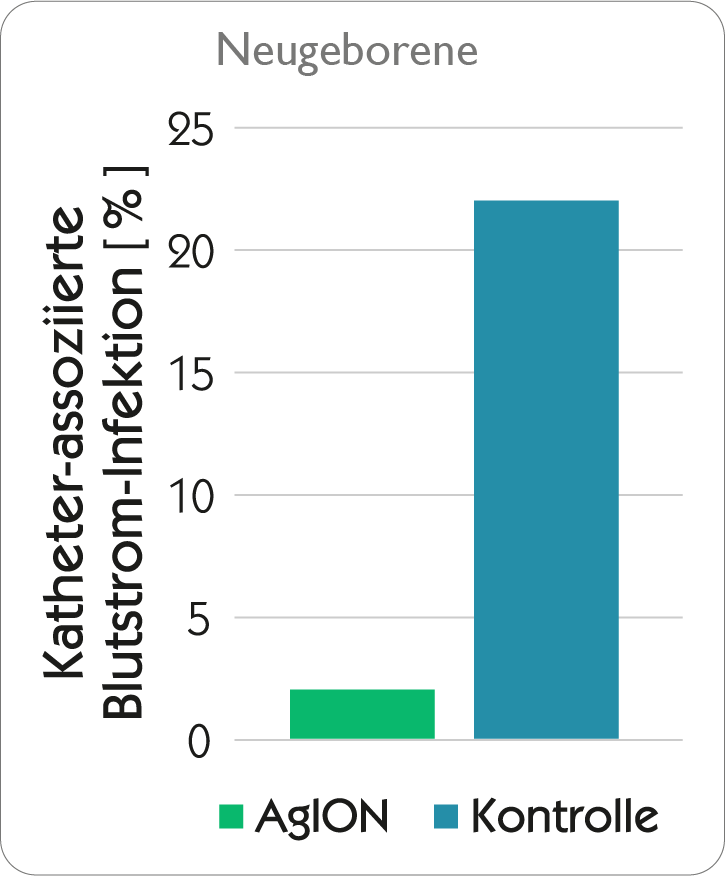
Katheterinfektionen gefährden besonders neugeborene und multimorbide Patienten mit schwachem Immunsystem nachdrücklich.
Lösungen
Mit einer genauen Analyse der Ursachen und dem Einsatz passender Wirkstoffkatheter lassen sich die Infektionsrisiken deutlich reduzieren.
Risiken
Zentrale Venenkatheter
Knapp 20.000 Patienten infizieren sich jährlich allein auf deutschen Intensivstationen. Für 45 % dieser nosokomialen Infektionen sind zentrale Venenkatheter verantwortlich.1 Besonders hämatologisch-onkologische Patienten, Dialysepatienten, Transplantationspatienten und Patienten der Pädiatrie/Neonatologie sind aufgrund ihres beeinträchtigten oder unausgereiften Immunsystems anfällig für eine katheterassoziierte Sepsis (CRBSI). 2

8400 ZVK-assoziierte Sepsisfälle
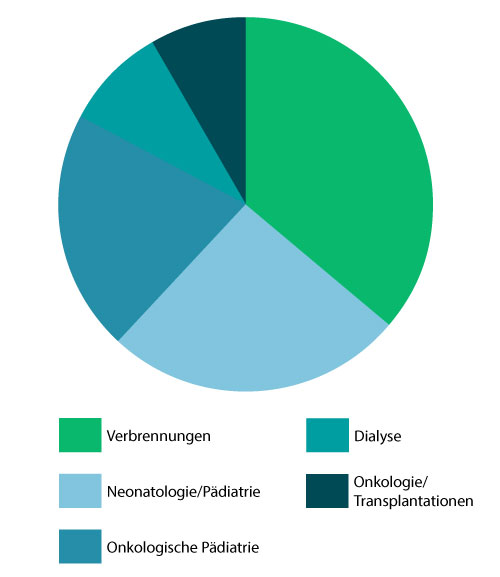
gefährdete Patientengruppen
Ursachen
Mikroorganismen
Die häufigste Ursache für katheterassoziierte Infektionen sind Mikroorganismen, die die Kathetereintrittsstelle und das Katheteransatzstück besiedeln. 3 Dabei lassen sich vier typische Ausgangspunkte für die CRBSI unterscheiden: Bereits bei der Katheteranlage können Keime durch den Stichkanal ins Gewebe und ins Gefäßsystem gelangen und die Katheteroberfläche besiedeln. Liegt der Katheter, ist jederzeit eine von der Eintrittsstelle ausgehende extraluminäre Besiedelung möglich. Genauso können Erreger vom Katheteransatzstück aus das Innenleben des Katheters intraluminär besiedeln oder ausgehend von einem katheterfernen Infektionsherd via hämatogener Streuung über die Blutbahn zum Katheter wandern.
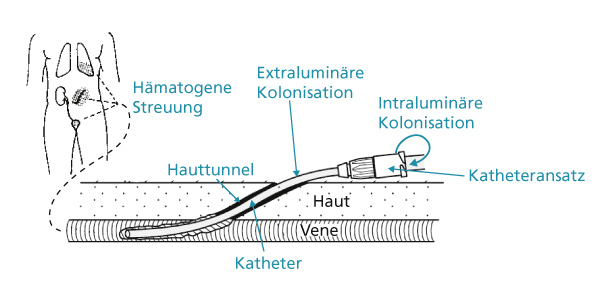
Ausganspunkte der katheterassoziierten Infektion
FOLGEN
Katheterassoziierte Infektionen
CRBSI GEFÄHRDET LEBEN UND BUDGETS
Katheterassoziierte Infektionen bergen gerade für multimorbide Intensivpatienten und andere vulnerable Gruppen signifikant erhöhte Mortalitätsrisiken. 2 Auch aus gesundheitsökonomischer Sicht stellen sie eine erhebliche Belastung dar.
Jährliche Mehrkosten in Deutschland
„In einer aktuellen Untersuchung aus Deutschland wurden pro CRBSI-Ereignis durchschnittliche Mehrkosten in Höhe von ca. 20.000 € ermittelt.“ 1
Bei 8.400 Fällen sind das 168 Millionen Euro.
Verdienstausfälle pro Fall
CRBSI-Patienten belegen Behandlungsplätze, die gegebenenfalls für andere Patienten vorgesehen sind, und verursachen damit laut einer Studie Krankenhaus-Verdienstausfälle von
27.000 US-Dollar pro Fall. 1
Richtlinien
Strategien zur Infektionsprävention
Zahlreiche Faktoren beeinflussen das CRBSI-Risiko – vom Material bis hin zum Anlageort des Gefäßkatheters. 2017 hat das Robert-Koch-Institut (RKI) dazu seine Empfehlung für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Einsatz nichtgetunnelter, zentralvenöser Katheter aktualisiert.1
Empfehlungen zur Vermeidung des Risikos gefäßkatheterassoziierter Infektionen
- Schulungen
- Maximale Barrieremaßnahmen und Hautantiseptik
- Ultraschallunterstützte Anlage von Gefäßkathetern
- Bestmöglicher Anlageort für ZVK
- Überprüfung der Indikation für Mehrlumenkatheter
- Verband an der Kathetereintrittsstelle
- Chlorhexidinfreisetzende Verbände am ZVK
- Antiseptische Ganzkörperwaschung von Intensivpatienten
- Liegedauer, Katheterwechsel, Wechsel über einen Führungsdraht
- Antiseptisch oder antibiotisch imprägnierte ZVK
- Übergeordnete Empfehlungen
- Surveillance und Konsequenzen erhöhter Infektionsraten

Für folgende Situationen empfiehlt die KRINKO den Einsatz antimikrobiell beschichteter ZVK 1
- „Nach einrichtungsspezifischer ärztlicher Risikoanalyse (…), wenn andere Maßnahmen keinen ausreichenden Effekt auf die Infektionsraten zeigen (Kat. IB).“
- „Nach individualmedizinischen Kriterien bei einzelnen, besonders gefährdeten Patienten, für die auch in Zukunft keine randomisierten kontrollierten Studien vorliegen werden (Kat. II).“
Lösung:
Das Vygon-
Kathetermanagement-Konzept
Als Spezialist für sichere Medizinprodukte haben wir ein Konzept zur
risikoabhängigen Katheterauswahl entwickelt, das je nach Krankheitsbild und Co-Morbidität auf antimikrobielle
Wirkstoffkatheter unterschiedlicher Bauart setzt: das Vygon-Kathetermanagement-Konzept. Damit sorgen Sie immer für den passenden Schutz.
Das Kathetermanagement Konzept
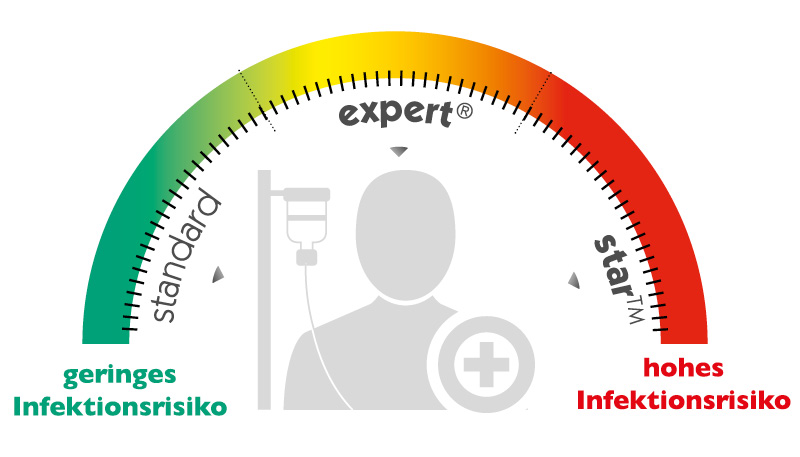
1. standard-Katheter aus Polyurethan
2. expert®-Katheter aus Silberionen-inkorporiertem Polyurethan
3. star™-Katheter aus Rifampicin/Miconazol-inkorporiertem Polyurethan
Unsere Lösungen
zur Vermeidung von Katheterinfektionen
Das Kathetermanagement-Konzept von Vygon hilft Ihnen den richtigen Katheter für Ihren Patienten auszuwählen. Je nach Krankheitsbild und Co-Morbidität sollte der richtige Katheter individuell ausgesucht werden, damit er Ihre Bemühungen zur Vermeidung von katheterassoziierten Infektionen erfolgreich ergänzt.
STANDARD-
TECHNOLOGIE
Zentralvenöse Sicherheits-Kathetersets nach Seldinger aus voll röntgenkontrastfähigem Polyurethan
EXPERT®–
TECHNOLOGIE
Katheter mit inkorporierter Silberionentechnologie – trimodal aktiv gegen die häufigsten Erreger
STAR™-
TECHNOLOGIE
Inkorporierte antimikrobielle Wirkstoffe senken das CRBSI-Risiko bei
Tumorpatienten um 91 %.4
expert®-Silberionentechnologie
Wirkstoffinkorporation
Wirkstofffreisetzung
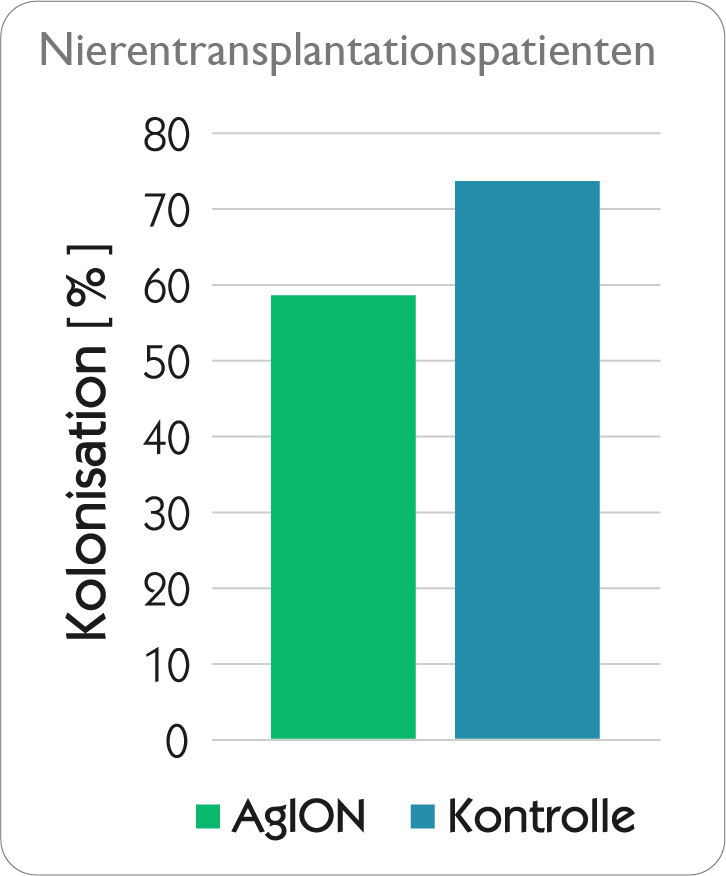
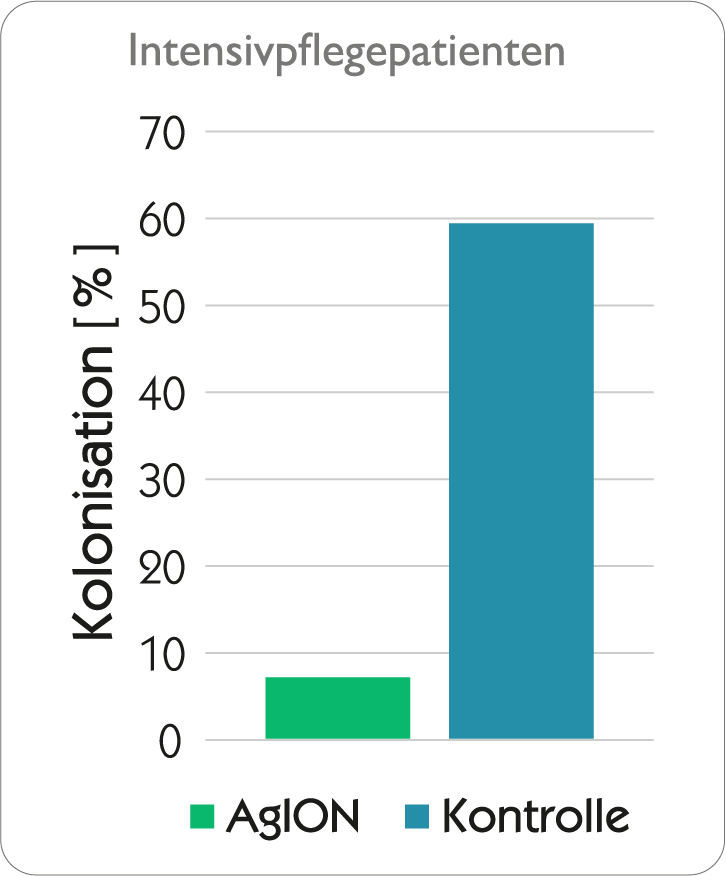
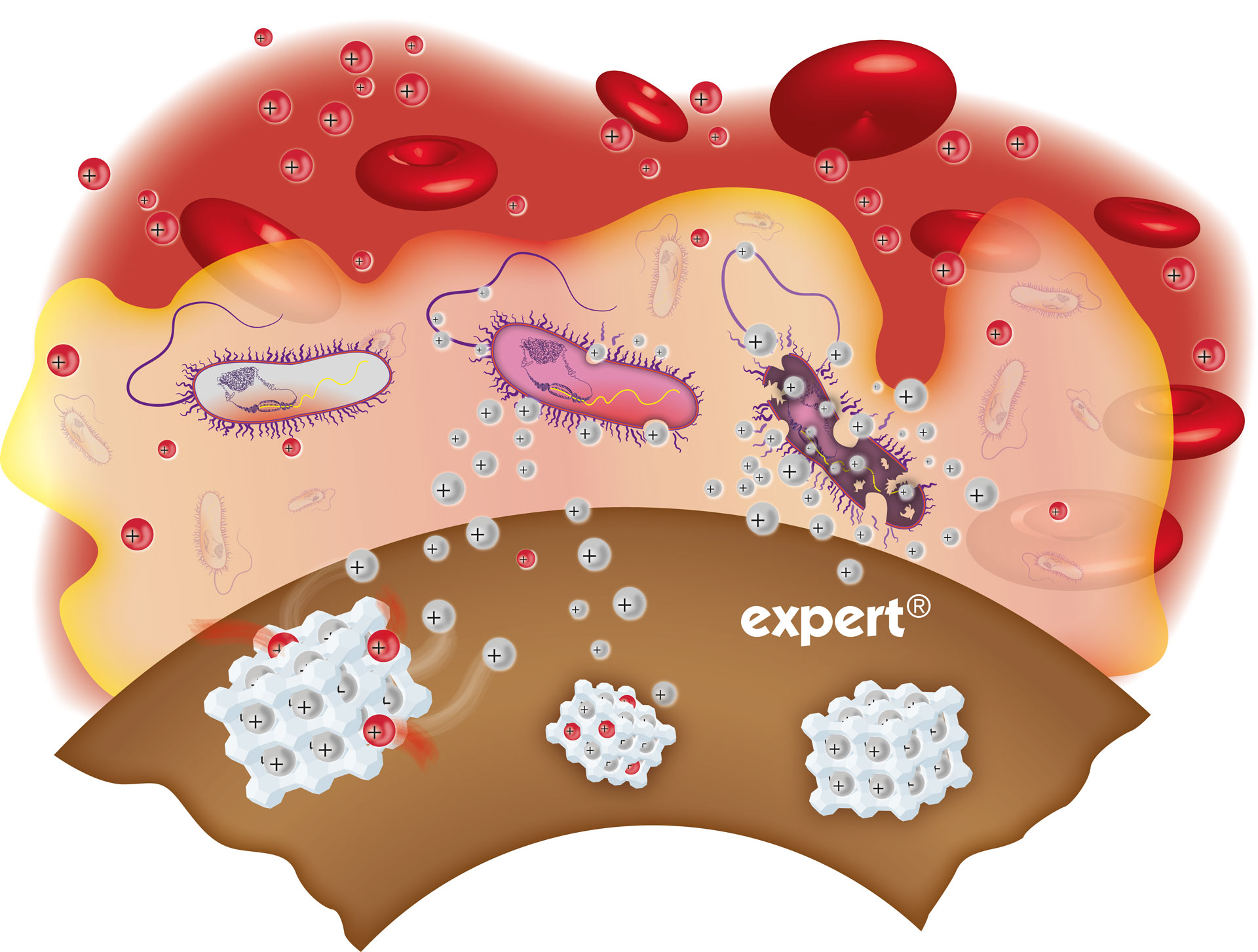
Bei Kontakt des Katheters mit Blut, Körperflüssigkeiten oder Infusionslösungen werden Silberionen sehr langsam und kontinuierlich mittels Ionenaustausch aus dem agion® Nature‘s antimicrobial-System freigegeben und unterdrücken so das mikrobielle Wachstum im Katheterlumen und im Biofilm des Katheters – dadurch wird das Auftreten Katheterassoziierter Sepsen auf ein Minimum reduziert! Aufgrund des enormen Wirkstoffdepots an Silberionen entfaltet sich die antimikrobielle Wirkung über die gesamte Einsatzdauer des Katheters
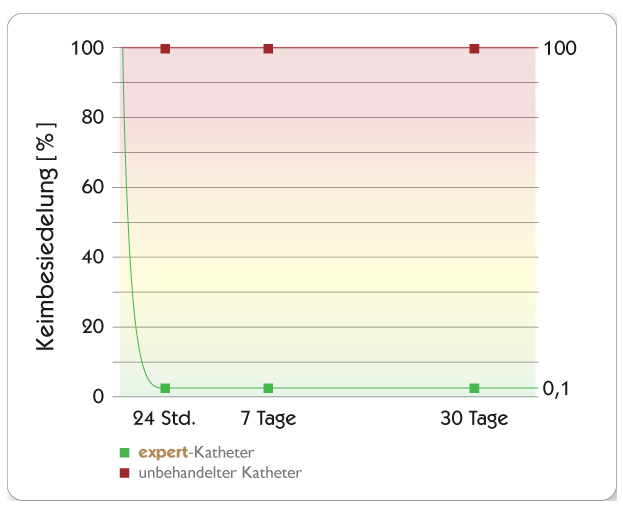
In vitro-Wirksamkeit
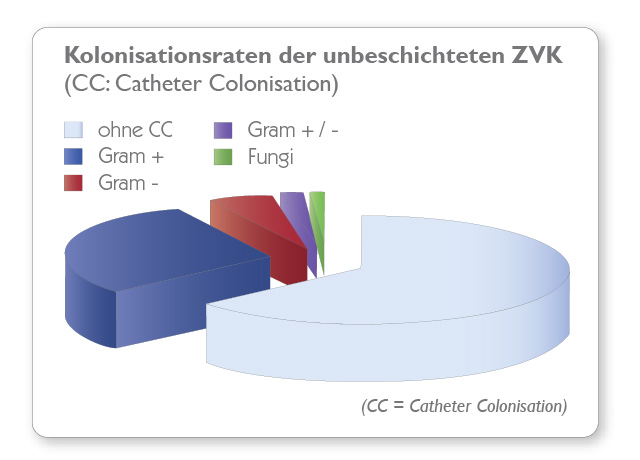
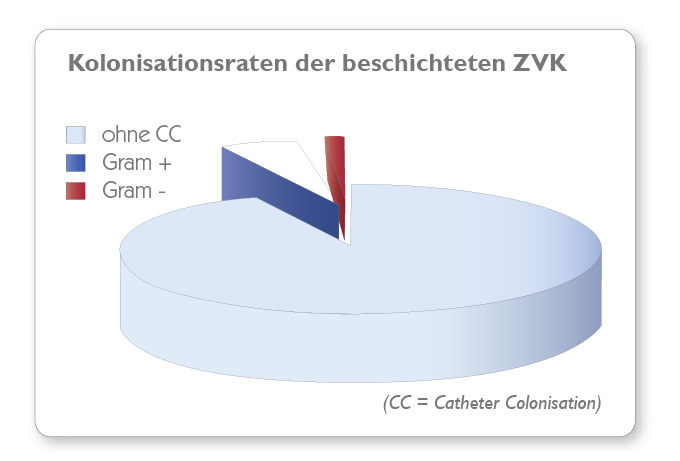
Tests mittels Dow Shaker Assay zeigen, dass die Konzentration von Mikroorganismen in Kontakt mit expert-Kathetern innerhalb von 24 Stunden um 99,9 % reduziert werden konnte und dass der expert®Katheter seine antimikrobielle Wirksamkeit auch nach 30 Tagen nicht verliert und deshalb langanhaltend antimikrobiell aktiv ist.
Klinische Wirksamkeit
agion® Nature‘s antimicrobial ist keine Beschichtung. Sie ist in das Kathetermaterial eingearbeitet und entfaltet
ihre antimikrobielle Wirkung über die gesamte Einsatzdauer des Katheters.
Silberionen werden über einen langen Zeitraum sehr langsam von den Katheteroberflächen freigegeben und gewährleisten dadurch einen langfristigen Schutz.
star-Technologie
Aktive Wirkstoffe
Zur Reduzierung Katheter-assoziierter Sepsen bei Hoch- risikopatienten bietet VYGON Katheter mit inkorporierten, antimikrobiell aktiven Wirkstoffen an: Rifampicin und Miconazol schützen den Katheter vor Keimbesiedelung und reduzieren dadurch das Risiko Katheter-assoziierter Infektionen auf ein Minimum.
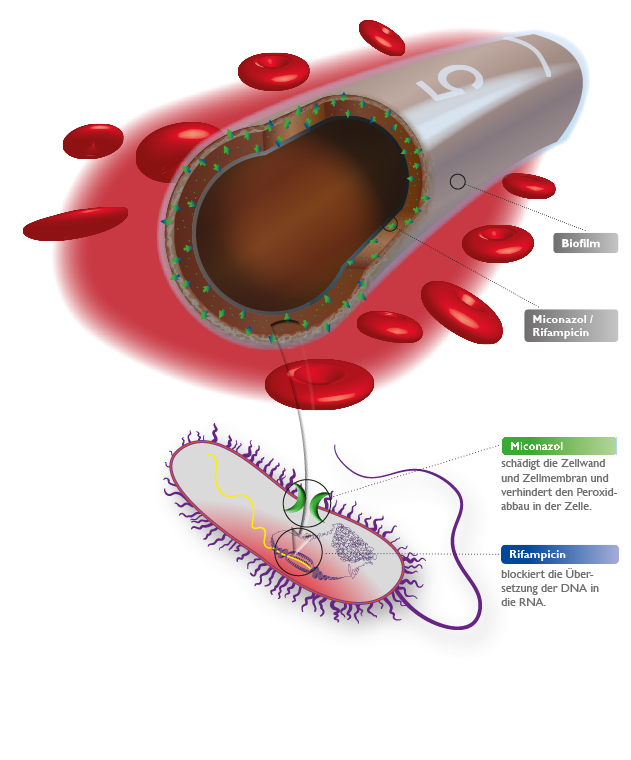
Wirkstoff-Freisetzung
Die gesamten Wirkstoffe werden nach einem patentierten Verfahren auf molekularer Ebene in das Kathetermaterial eingearbeitet, welches als Wirkstoffreservoir dient.
Kontinuierlicher Schutz durch Diffusion
- Freigabe der Wirkstoffe durch Kontakt mit Körperflüssigkeiten oder Infusionslösungen (Slow-Release-System)
- Unterdrückung der mikrobiellen Besiedlung an der gesamten Katheteroberfläche (innen und außen)
- Wirkstoffe durchfluten ebenfalls den Protein-Biofilm, der sich an der Katheteroberfläche bei Blutkontakt bildet
Enormes Wirkstoffdepot
- in der Katheterwandung
- die antimikrobielle Wirkung entfaltet sich über die gesamte Einsatzdauer des Katheters aufgrund der Depotwirkung
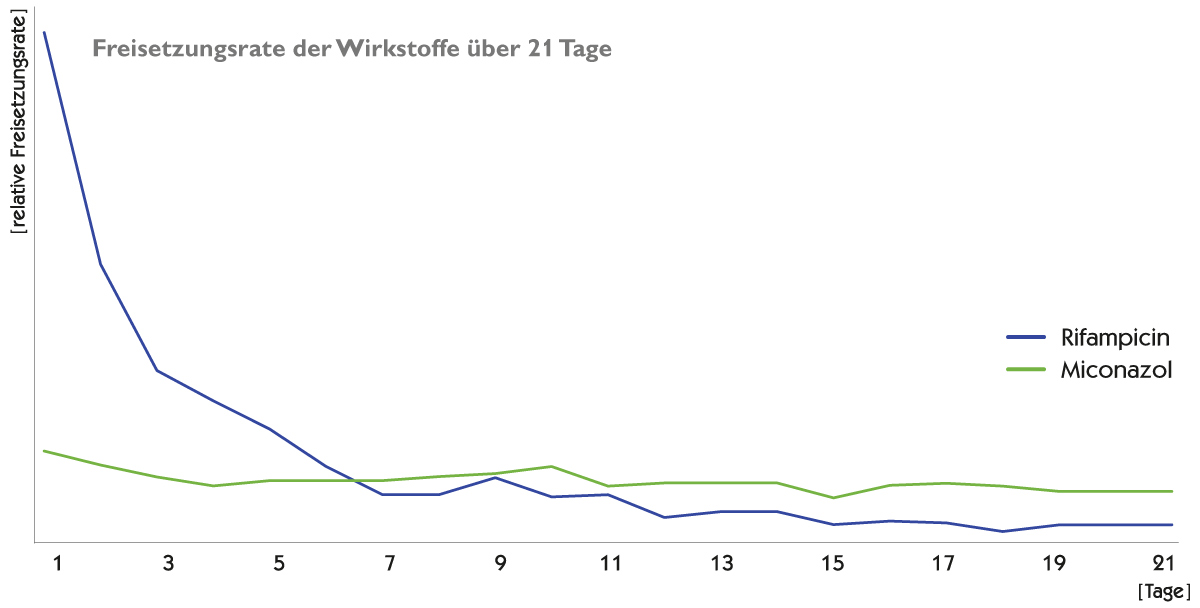
Freisetzungsrate der Wirkstoffe über 21 Tage 2
Klinische Wirksamkeit
Die klinische Wirksamkeit der star™-Technologie wurde in zwei kontrollierten klinischen Studien mit insgesamt 648 Individuen sowie einer retrospektiven Kohorten-Studie nachgewiesen.
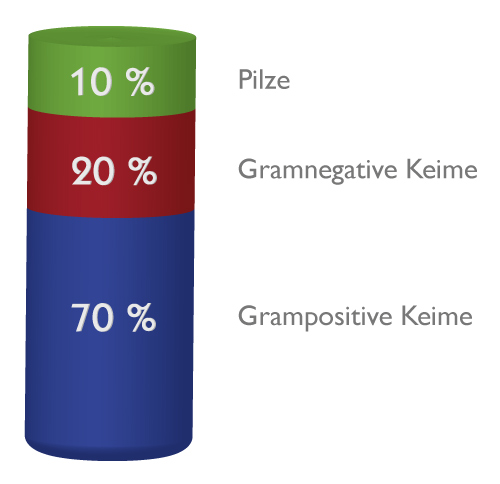
Wirkspektrum
- Die aktiven Wirkstoffe sind abgestimmt auf die bei Katheter-assoziierten Infektionen am häufigsten auftretenden Keime (70% Grampositive Keime, 20% Gram negative Keime und 10% Pilze)
- Das Wirkspektrum beider Wirkstoffe ist stark überlappend und synergistisch, z.B. bei Staphylococcus epidermidis- und Candida-Infektionen2
Aktive Wirkstoffe wirken lokal
Mediathek
bionector
Mit neutralem Spülvolumen und Split Septum
Welcher ZVK für welchen Patienten?
Das Vygon-Kathetermanagement-Konzept hält für jede Risikoklasse die passende Lösung bereit.
Vygon-Wirkstoffkatheter: die Technologien
Wirkstoffkatheter-Expertin Dr. Jennifer Wessling erläutert die Idee hinter expert® und star™.
Die star™-Technologie, kurz erklärt
Optimal für Patienten mit eingeschränkter Immunabwehr: multistar®, premistar® und Co.

Expertenmeinung
Das sagen Anwender über die star™-Technologie:
Die einzigartige Kombination von staphylokokkenwirksamem Miconazol und Rifampicin, mikroskopisch fein verteilt im gesamten Kathetermaterial, sorgt für eine klinisch nachgewiesene Wirksamkeit von über 3 Wochen – mit einem breiten Schutz gegen grampositive und gramnegative Keime und Pilze. Krebspatienten, immungeschwächte und kritisch kranke Patienten, die lange einen zentralen Zugang benötigen, profitieren besonders von diesen Kathetern, weil sie die Gefahr einer Besiedelung um 84–90 % und das Risiko einer Kathetersepsis um ca. 75–90 % reduzieren. Rifampicin-Miconazol-haltige Mikrokatheter stellen zudem eine sinnvolle Erweiterung des Armamentariums gegen Infektionen in der Neonatologie dar.
FAQ – RUND UM STAR™
Hier finden Sie alle Antworten auf Ihre Fragen zur star™-Technologie.

Ist die Wirksamkeit rifampicinhaltiger Katheter klinisch getestet worden?
Ja. Eine Studie von Yuecel et al. sowie zwei Studien von Lorente et al. zur Reduktion katheterassoziierter Infektionen durch den Einsatz rifampicin- und miconazolhaltiger Katheter zeigen die signifikante Senkung der Rate katheterassoziierter Infektionen und der Bakteriämierate. Das Risiko einer Besiedlung des Katheters ist in der Studie von Yuecel et al. durch den Einsatz rifampicin- und miconazolhaltiger Katheter auf rund 1:10 reduziert. Die Studien von Lorente et al. stellen die signifikante Senkung der Bakteriämierate (0 vs. 8 %) durch den Einsatz rifampicin- und miconazolhaltiger Katheter auch bei einer Liegedauer von mehr als drei Wochen heraus.2
Wie sieht das Wirkspektrum der star™-Katheter aus?
TRBA ist die Abkürzung für Technische Regeln für Biologische Arbeitsstoffe.
Rifampicin ist hoch wirksam sowohl gegen schnell wachsende als auch gegen stoffwechselinaktive Mikroorganismen in Biofilmen. Miconazol zeigt neben seiner fungiziden Wirkung auch eine Hemmwirkung gegenüber grampositiven Bakterien wie z. B. S. aureus und S. epidermidis. Damit zeigt der Katheter ein Wirkspektrum über z. B. S. epidermidis, S. aureus, E. faecalis, P. aeruginosa, E. coli, Enterobacter und C. albicans.
Bekanntes Wirkspektrum von star™-Kathetern 3
| Erreger | Häufigkeit (%) |
| Staphylococcus epidermidis | 40–60 |
| S. aureus | 5–10 |
| Pseudomonas aeruginosa | 3–6 |
| Enterobacter spp. | 1–4 |
| Candida spp. | 2–5* |
* 10 % bei Transplantations- und Onkologie-Patienten 2
Sind die Wirkstoffe mit MRSA-Erregern getestet worden?
Ja. star™-Katheter zeigen Hemmwirkung gegenüber MRSA-Erregern.
Ist eine Testung der Katheterspitze möglich und sinnvoll?
Ja, die Testung der Katheterspitze ist möglich und zur Diagnostik in der Klinik gemäß den dort geltenden Vorschriften durchaus sinnvoll. Bei Bedarf bieten wir Ihnen an, uns Katheterfragmente zurückzusenden. In diesem Fall lassen wir die Wirksamkeit und das Erregerspektrum des Katheterfragments nach seiner Entfernung untersuchen.
Geben größere Katheter mehr Antibiotika ab?
Ja. Der Wirkstoff ist in die Katheterwand inkorporiert. Die Abgabe des Wirkstoffs ist abhängig von der vorhandenen Oberfläche, die mit Flüssigkeit in Kontakt steht.
Ist die Menge des im Katheter vorhandenen Antibiotikums auf die Kathetergröße abgestimmt?
Ja. Durch die Inkorporation der Wirkstoffe in die Katheterwandung ist die Menge der Wirkstoffe immer auf die Kathetergröße abgestimmt.
Wirken die Wirkstoffe tatsächlich nur am Protein-Biofilm?
Die Katheterwandung dient als Wirkstoffdepot und gewährleistet aufgrund der hohen lokalen Konzentration einen optimalen Schutz der Katheteroberfläche und des darauf liegenden Protein-Biofilms. Die Wirkstoffe diffundieren durch die Katheterwand in den Protein-Biofilm und hemmen dort das Wachstum von Bakterien und Pilzen. Sobald die Wirkstoffe durch den Protein-Biofilm durchquert haben, verdünnt der Blutstrom sie sofort in nicht-wirksame Konzentrationen.
Wie ist eine anfängliche Anflutung der Wirkstoffe zu erklären, wenn doch durch die Inkorporation des Wirkstoffes eine Abgaberate definiert ist?
Bei der anfänglichen Anflutung der Wirkstoffe handelt es sich um einen Oberflächeneffekt, den sogenannten Burst-Effekt. Er dauert an, bis sich die Diffusion der Wirkstoffe im Equilibrium befindet, das dann eine gleichmäßige Abgaberate der Wirkstoffe über die gesamte Liegedauer gewährleistet.
Ist Rifampicin noch das Antibiotikum der Wahl?
Rifampicin ist aus den folgenden Gründen ein idealer Wirkstoff zum Schutz vor katheterassoziierten Infektionen: Rifampicin ist biofilmaktiv, wirkt schnell bakterizid und zeigt eine breite Wirkung gegen eine Vielzahl von Bakterienstämmen aus dem Erregerspektrum katheterassoziierter Infektionen.
Welche Vorteile bietet der star™-Katheter im Vergleich zu Wettbewerbsprodukten?
Antibiotikahaltige Wettbewerbsprodukte sind nur mit Rifampicin beschichtet, während star™-Katheter mit den Wirkstoffen inkorporiert sind. Diese Inkorporation gewährleistet einen vollständigen und über die gesamte Liegedauer von 29 Tagen andauernden Schutz vor katheterassoziierten Infektionen. Darüber hinaus setzen star™-Katheter als einzige Lösung zusätzlich auf den Kombinationspartner Miconazol, der den Katheter wirksam gegen Pilzinfektionen schützt. Gleichzeitig reduziert die Kombination von Rifampicin und Miconazol durch ihr überlappendes Wirkspektrum das Risiko von Antibiotika-Resistenzen.
Wie groß ist das Risiko einer Antibiotikaresistenz durch den star™-Katheter?
Die hohe lokale Wirkstoffkonzentration am Katheter und die sofortige Wirkstoffverdünnung im Blut senken das Risiko von Antibiotikaresistenzen. Auch die intelligente Kombination von Wirkstoffen mit überlappendem Wirkspektrum hilft, Resistenzen vorzubeugen.
Sind Resistenzen bekannt?
Nein, zum heutigen Zeitpunkt sind keine Resistenzen bekannt. Der HTA-Bericht des DIMDI von 2012 empfiehlt, beim Einsatz wirkstoffhaltiger Katheter die Ausbildung von Resistenzen zu beobachten, z. B. durch eine routinemäßige Kontrolle der gezogenen Katheterspitzen auf Erreger. 2 Solche Untersuchungen lassen wir gern für Sie durchführen, wenn Sie uns die Katheterspitzen schicken.
Gibt es Studien, die das Risiko einer Resistenzentwicklung analysiert haben?
Gibt es Antibiotikaallergien?
Eine bekannte Überempfindlichkeit gegen Rifampicin oder Miconazol ist eine Kontraindikation für den Einsatz von star™-Kathetern.
Wie lange darf der star™-Katheter liegen?
Wir empfehlen eine maximale Katheter-Liegedauer von 29 Tagen.
Gibt es Kontraindikationen?
Verwenden Sie dieses Produkt nicht bei Patienten mit:
- bekannter Überempfindlichkeit gegen Rifampicin oder Miconazol
- vorliegenden Anzeichen einer Schwangerschaft
- schweren Leberfunktionsstörungen